
Siendo A(g) los átomos neutros de una sustancia elemental en estado gaseoso; EI, la energía de ionización y
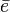 un electrón.
un electrón.Esta energía corresponde a la primera ionización. El segundo potencial de ionización representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ion positivo es menor que el del átomo y la fuerza electrostática es mayor en el ion positivo que en el átomo, ya que se conserva la misma carga nuclear.
El potencial o energía de ionización se expresa en el electrón-voltio , julios o en kilo Julios por mol (kJ/mol).
1 eV = 1,6 × 10-19 C × 1 V = 1,6 × 10-19 J
En los elementos de una misma familia o grupo el potencial de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.
Sin embargo, el aumento no es continuo, pues en el caso del berilio y del nitrogeno ,se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo período. Este aumento se debe a la estabilidad que presentan las configuraciones s2 y s2 p3,respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar los electrones.
Potencial de ionización
El Potencial de ionización (P&) es la energía mínima requerida para separar un electrón de un átomo o molécula especifica a una distancia tal que no exista interacción electrostática entre el ion y el electrón. Inicialmente se definía como el potencial mínimo necesario para que un electrón saliese de un átomo que queda ionizado. El potencial de ionización se medía en voltios . En la actualidad, sin embargo, se mide en electrón-voltios (aunque no es una unidad del SI) o en julios por mol. El sinónimo energía de ionización (El) se utiliza con frecuencia. La energía para separar el electrón unido más débilmente al átomo es el primer potencial de ionización; sin embargo, hay alguna ambigüedad en la terminología. Así, en quimica, el segundo potencial de ionización del litio es la energía del proceso.
En fisica, el segundo potencial de ionización es la energía requerida para separar un electrón del nivel siguiente al nivel de energía más alto del átomo neutro o molécula, p.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Periodo | |||||||||||||||||||
| 1 | H 1312 | He 2372 | |||||||||||||||||
| 2 | Li 520 | Be 899 | B 800 | C 1086 | N 1402 | O 1313 | F 1681 | Ne 2080 | |||||||||||
| 3 | Na 496 | Mg 738 | Al 577 | Si 786 | P 1012 | S 1000 | Cl 1251 | Ar 1521 | |||||||||||
| 4 | K 419 | Ca 590 | Sc 633 | Ti 659 | V 651 | Cr 653 | Mn 717 | Fe 762 | Co 760 | Ni 737 | Cu 745 | Zn 906 | Ga 579 | Ge 762 | As 947 | Se 941 | Br 1140 | Kr 1351 | |
| 5 | Rb 403 | Sr 549 | Y 600 | Zr 640 | Nb 652 | Mo 684 | Tc 702 | Ru 710 | Rh 720 | Pd 804 | Ag 731 | Cd 868 | In 558 | Sn 708 | Sb 834 | Te 869 | I 1008 | Xe 1170 | |
| 6 | Cs 376 | Ba 503 | Lu 523 | Hf 658 | Ta 761 | W 770 | Re 760 | Os 840 | Ir 880 | Pt 870 | Au 890 | Hg 1007 | Tl 589 | Pb 715 | Bi 703 | Po 812 | At 920 | Rn 1037 | |
| 7 | Fr 380 | Ra 509 | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | |

No hay comentarios:
Publicar un comentario